分子科學與生物醫學實驗室在細胞相互作用界面調控及T細胞信号轉導研究中取得重要突破
通訊員:堵玉林 發布時間:2023-04-04 浏覽量:次
近日,2003网站太阳集团分子科學與生物醫學實驗室(MBL)研究報道了一種膜錨定的DNA納米平台,可用于精确控制APC-T細胞接觸區的膜間距離以深入研究T細胞信号轉導的分子機制。相關研究成果以題為“Membrane-anchored DNA nanojunctions enable closer antigen-presenting cell–T-cell contact in elevated T-cell receptor triggering”(DOI:10.1038/s41565-023-01333-2)的研究論文在國際頂級期刊《Nature Nanotechnology》在線發表。
衆所周知,T細胞介導的适應性免疫在對抗許多疾病中發揮着至關重要的作用。該過程是由T細胞表面受體(TCR)與抗原呈遞細胞(APC)表面的抗原肽-主要組織相容性複合物(pMHC)結合所啟動。在TCR與pMHC結合後,TCR複合物胞内結構域中的免疫受體酪氨酸基激活基序(ITAM)将被Src家族的酪氨酸激酶Lck磷酸化,導緻激酶ZAP-70的募集和激活,進而磷酸化銜接蛋白LAT,以觸發下遊信号級聯反應,最終導緻T細胞的活化。在T細胞活化這樣一個由多種分子參與并發生相互作用的複雜過程中,盡管TCR與pMHC結合起着重要作用,但關于TCR-pMHC具體如何參與啟動細胞内信号級聯的分子機制仍存在争議。
TCR與pMHC連接後,會招募多個輔助分子以在APC和T細胞相互作用的界面處形成緊密接觸區域。TCR-pMHC複合物的尺寸約為13 nm,意味着APC-T細胞接觸區的軸向距離維持在一個很小的尺度。此前已有報道通過延長pMHC配體及其他蛋白研究了接觸區域的空間因素對TCR信号通路的影響。但這些策略難以測量膜間距離和TCR信号通路之間的線性關系,并且涉及蛋白質結構和表達的變化,可能會導緻相互矛盾的結果。人工制造的納米界面能夠提供可測量的模型,但它們在許多固有的膜相關分子和适應性形态方面存在缺陷,不可避免地導緻其在代表真實APC方面的局限性。此外,簡化模型雖然更易研究,但想要實現對這一複雜生物過程相對全面的了解仍面臨巨大挑戰。迄今為止報道的策略僅側重于延長膜間間隔,很少有人試圖探索壓縮膜間距離這一操作所産生的影響,這在機制研究中不可避免地留下了空白。
有鑒于此,譚蔚泓教授和邱麗萍教授團隊通過将膽固醇标記的DNA四面體(TDN)作為細胞膜錨定支架構建出不同尺寸的DNA納米連接子(DNJ),在真實的T細胞和樹突狀細胞(DC)相互作用體系中對TCR-pMHC介導的接觸區域的軸向空間距離進行延長、維持和壓縮操作,在保持細胞自然生理狀态的前提下,探讨T細胞活化過程的分子機制。

圖1. DNJ精确操縱DC-T細胞緊密接觸區的軸向距離。
基于這種可編程的膜錨定DNA納米平台,該研究首次在真實的DC-T細胞相互作用體系中,實現了TCR-pMHC周圍緊密接觸區軸向空間距離的精準測量和調控。該研究表明在臨界低表面密度下,尺寸超過TCR-pMHC複合物尺寸的DNJ-37可以通過延長膜間距離削弱CD45分離來抑制T細胞激活信号,小尺寸的DNJ-7能夠壓縮DC-T細胞界面處的膜間間隔,并通過導緻CD45嚴格外排和TCR構象改變實現T細胞活化的強烈增強。這些研究結果為緊密接觸區的軸向尺寸在T細胞觸發中的重要作用提供了直接證據,并且通過縮短DC-T細胞界面可以顯著增強T細胞活化水平,為T細胞免疫研究拓寬了窗口。此外,該研究開發的膜錨定DNA納米平台,具有高可編程性、高可控性、方便操作和良好的生物相容性等優勢,有望為細胞-細胞相互作用過程中的分子事件研究提供新範式。
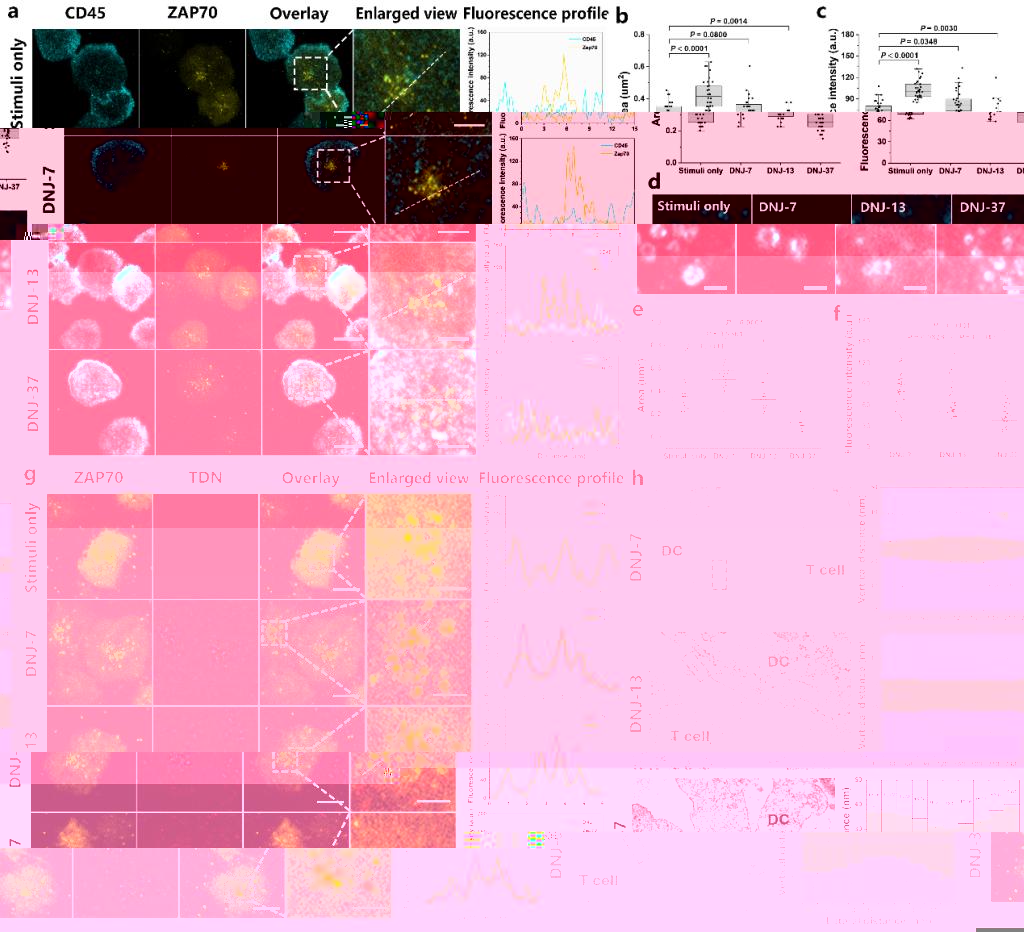
圖2. T細胞受體信号傳導的分子機制研究。
2003网站太阳集团分子科學與生物醫學實驗室(MBL)、化學生物傳感與計量學國家重點實驗室、2003网站太阳集团譚蔚泓教授和邱麗萍教授為該工作的通訊作者,2003网站太阳集团博士生堵玉林和呂一帆副教授為該工作的第一作者。該工作得到了來自國家重點研發計劃、國家自然科學基金、湖南省科技創新項目、深圳市優秀科技創新人才培養項目等項目的資助。