聶舟教授團隊在細胞人工機械力受體方向取得重要進展
通訊員: 發布時間:2024-03-19 浏覽量:次
近日,2003网站太阳集团聶舟教授團隊取得最新研究進展,開發了一種創新的DNA功能化人工機械力受體(AMR),為機械生物學和生物醫學應用開辟了新的可能性。
機械力信号在細胞通訊中扮演着至關重要的角色,它影響細胞的穩态維持、發育進程和病理變化。2021年諾貝爾生理醫學獎的獲獎成果之一——機械力受體Piezo的研究,凸顯了細胞機械響應在生命科學中的關鍵作用。細胞通過天然機械力受體(如整合素、鈣粘蛋白、T細胞受體和Notch受體)感知并響應外部力信号,從而啟動一系列信号轉導過程,調控細胞特定行為。
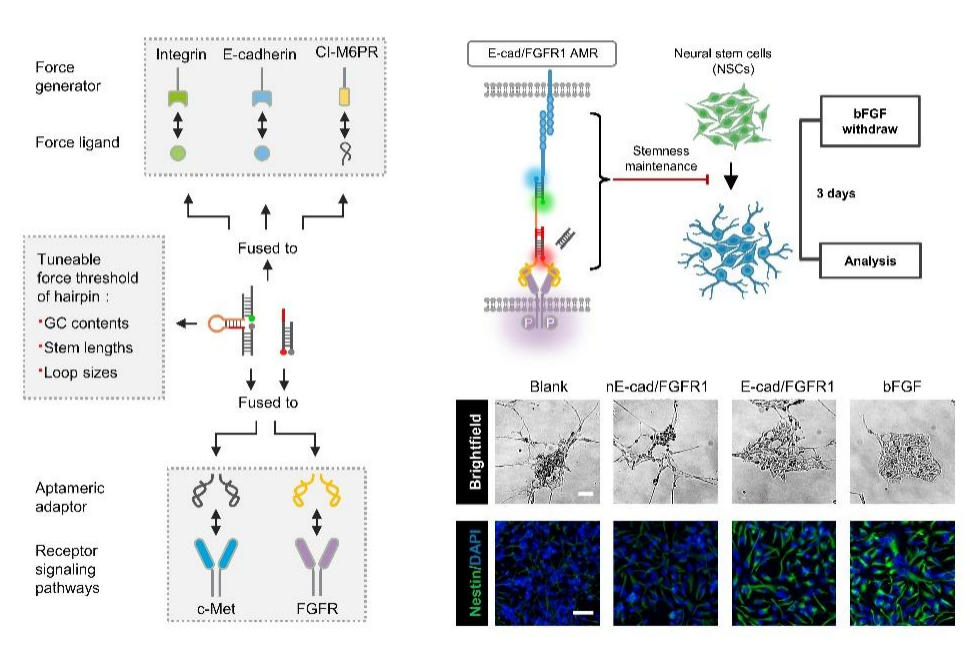
聶舟教授團隊開發了一種從頭設計的人工機械力受體(AMR),它是一種模塊化的DNA-蛋白質嵌合平台,包含通用的機械感知和傳遞DNA(GMD)納米器件。AMR能夠将原本不具備機械力感應功能的細胞表面受體(如受體酪氨酸激酶,RTKs)重新編程,使其對特定力刺激産生響應。與傳統的基因工程改造方法相比,AMR通過化學合成的DNA納米器件,以一種無需基因改造的非遺傳方式對天然細胞表面受體進行調控,展現了很高的适用性和獨特優勢。

研究團隊利用原子力顯微鏡、共聚焦激光掃描顯微鏡和dSTORM超分辨成像技術,展示了AMR在細胞膜上的力響應和信号激活性能。該研究發現通過對DNA序列進行簡單編程,可以精确調控AMR的力響應阈值,實現在生理條件下皮牛(pN)範圍内的精确控制。此外,AMR展現出優秀的通用性,能夠靈敏地感知多種細胞産生的力,并調節不同的非機械響應性細胞表面受體。
AMR的設計不僅在細胞力學信号系統重編程方面展現出巨大潛力,還在神經幹細胞(NSCs)的幹性維持中證明了其生物學功能。通過AMR介導的FGFR1信号通路重編程,在無需外源生長因子的情況下,僅通過細胞間的粘附力就可以維持NSCs的幹細胞特性,為優化NSCs的體外培養及其臨床應用提供了新思路。AMR策略為深入探索力學生物學原理以及在再生醫學領域開發新型細胞療法提供了全新的化學工具,具有重要的科學和臨床應用價值。
相關研究成果以“DNA-functionalized Artificial Mechanoreceptor for de novo Force-responsive Signaling”為題發表在Nature Chemical Biology雜志上。2003网站太阳集团化學生物傳感與計量學國家重點實驗室聶舟教授為唯一通訊作者,2003网站太阳集团為唯一通訊單位。2003网站太阳集团博士研究生楊思慧為文章的第一作者。

該工作得到了中國科學院力學研究所龍勉研究員和呂守芹研究員團隊在原子力顯微鏡測試和成像實驗方面的技術支持、中國科學院大連化學物理研究所陸瑤研究員團隊在高密度微孔陣列芯片制備方面提供的技術協助、中國科學院長春應用化學研究所王宏達研究員團隊在dSTORM成像和數據分析方面提供的技術協助。該工作得到了國家重點研發計劃和國家自然科學基金的支持。